La dysplasie coxo-fémorale : où en est-on ?
La dysplasie coxo-fémorale, plus communément appelée dysplasie de la hanche, est une affection de l’appareil ostéoarticulaire particulièrement répandue dans l’espèce canine. Elle affecte préférentiellement les races de grande taille à croissance rapide.
C’est une maladie génétique et exclusivement génétique, et de ce fait, transmissible à la descendance. Des facteurs extérieurs appelés environnementaux peuvent moduler l’extériorisation et l’intensité des signes cliniques mais ne sont en aucun cas eux mêmes la cause de la maladie.
Le meilleur traitement est préventif et consiste à dépister les chiens reproducteurs et à écarter les animaux atteints du circuit de la reproduction.
J’avais déjà consacré trois articles sur ce sujet dans le bulletin, le premier datant de 2005. Depuis les critères de lecture des radiographies des hanches ont été revus en 2006 puis en mai 2022 à la suite des progrès apportés par la diffusion des clichés numériques et les outils informatiques d’aide à leur interprétation. Il était donc intéressant de reprendre le sujet.
DÉFINITION ET GÉNÉRALITÉS
Le comité scientifique de la FCI définit la dysplasie coxo fémorale comme suit:Trouble du développement de la hanche correspondant à une instabilité de l’articulation qui détermine à plus ou moins long terme une déformation des surfaces articulaires et l’installation d’un processus arthrosique.
Une articulation est le point de rencontre entre deux os, unis entre eux par des ligaments, et destinés à être mobiles l’un par rapport à l’autre. Elle est entourée d’un manchon protecteur appelé capsule articulaire. Les surfaces osseuses en contact sont appelées surfaces articulaires et sont recouvertes d’un cartilage destiné à faciliter les mouvements des os entre eux, l’ensemble baignant dans un liquide appelé liquide synovial et
qui fait office de lubrifiant. Une articulation dysplasique est une articulation qui a subi une anomalie dans son développement. Les mouvements y sont anormaux engendrant des contraintes mécaniques inhabituelles sur les os qui la constituent, d’où une usure prématurée de leurs surfaces articulaires et le développement d’une arthrose précoce se traduisant cliniquement par une douleur et une boiterie plus ou moins handicapantes pour l’animal.
L’articulation coxo-fémorale unit le fémur à l’os coxal, ce volumineux os qui forme le bassin. L’os coxal est creusé d’une cavité appelée acétabulum (également appelé cotyle notamment en médecine humaine) dans laquelle s’emboîte complètement la tête du fémur. Celle-ci est attachée au fond de l’acétabulum par un ligament unique appelé ligament rond. L’articulation est entourée d’une capsule, première victime de la dysplasie.
Le point de départ de la maladie est une hyper laxité de l’articulation et principalement, une hyper laxité de la capsule articulaire. Cela signifie que la capsule articulaire voit sa capacité à être étirée nettement augmentée car sa fermeté a été altérée. Le ligament rond n’est quant à lui que peu concerné, son rôle se limitant principalement à celui d’un amortisseur pour absorber les chocs entre la tête du fémur et l’acétabulum. Il en résulte que, lors des mouvements des pattes arrière, la tête fémorale ne reste pas à sa place au fond de l’acétabulum mais a, en permanence, tendance à en sortir: on parle de mouvements de subluxation. Ce sont ces mouvements anormaux qui seront à l’origine de l’usure et de la déformation prématurée des surfaces articulaires, notamment au niveau des rebords de la cavité acétabulaire (encore un autre vocable pour désigner l’acétabulum) et de l’apparition de l’arthrose.
LA DYSPLASIE COXO-FÉMORALE, MALADIE GÉNÉTIQUE À EXPRESSION PHÉNOTYPIQUE VARIABLE.
Avant d’aborder les deux chapitres à venir, deux définitions méritent d’être rappelées.
On appelle génotype l’ensemble des gènes présent dans les cellules de l’organisme. Il n’est visible qu’en laboratoire. Une grande partie de ces gènes reste silencieuse. Seuls quelques gènes vont s’exprimer, conférant à chaque être vivant ses caractéristiques propres visibles à l’œil nu. L’ensemble de ces caractéristiques observables constitue le phénotype, la partie visible de l’iceberg. Mais ce qui est silencieux continue de se transmettre à la descendance pour ne parfois prendre la parole que bien des générations plus tard.
Il est à présent unanimement admis que la dysplasie de hanche, comme celle du coude d’ailleurs, est d’origine génétique et exclusivement génétique, donc transmissible à la descendance.
Malgré les nombreux progrès effectués en génétique canine, beaucoup de points restent à ce jour sans réponse et, malgré quelques coups de pub émanant de certains laboratoires, aucun test de dépistage génétique fiable n’est disponible à ce jour. Le sera-t-il un jour? Pas sûr!
Le mode de transmission répond aux lois de la génétique quantitative. Il était classique de le qualifier de multigénique à seuil. Multigénique signifie que plusieurs gènes sont concernés. La notion de seuil sous-entend qu’il faut que le nombre de gènes présents chez l’animal et codant pour la dysplasie soit supérieur à un certain total pour que l’animal soit dysplasique. Le caractère multigénique reste aujourd’hui admis mais sans qu’on sache combien de gènes sont concernés, quelles sont les interactions entre ces gènes ni s’ils ont tous le même« poids».
Faut-il oublier la notion de seuil? Aucune réponse à ce jour. Des travaux effectués chez le Berger Allemand laissaient à penser qu’il existait, dans le pool des gènes codants, un gène majeur dont la présence seule conférait à l’animal qui le portait le génotype dysplasique. Un test génétique avait même été commercialisé. Cette théorie n’est pour l’heure plus d’actualité, le test s’étant par ailleurs avéré non fiable.
Certains pensent qu’il existe deux types de gènes codants. Des gènes communs à tous les chiens et d’autresayant une spécificité raciale. Un vaste programme de recherche multidisciplinaire a été débuté par l’équipe de génétique canine du Dr. Catherine André (CNRS- Université de Rennes 1), programme qui fit l’objet d’une visioconférence avec le RCF en 2022.
Après avoir effleuré le génotype, venons-en à ce qui est visible, le phénotype dysplasie. J’avais écrit que cette maladie était une maladie génétique à expression phénotypique variable. En effet, certains facteurs extérieurs, appelés facteurs environnementaux, vont pouvoir influencer l’apparition des signes cliniques de dysplasie et leur intensité. Ils peuvent influencer, faire varier le phénotype dysplasie. Nous avons bien dit influencer et non provoquer ou faire disparaitre.Le génotype dysplasique est présent ou pas chez un individu donné, seule son expression clinique peut être modulée chez cet individu. D’où la notion d’héritabilité.
L’HÉRITABILITÉ
L’héritabilité est une donnée statistique relative à une popula tion, en l’occurrence ici, à une race canine.Sa valeur relève d’un calcul mathématique. Elle représente le« poids» des facteurs génétiques dans l’expression clinique de la maladie héréditaire concernée. Elle explique de ce fait la variabilité des phénotypes entre individus ayant un patrimoine génétique identique. Elle varie de O à 1 et est souvent exprimée en pourcentage.
Une héritabilité à 1 (100%) signifie que les facteurs environne mentaux sont incapables d’influencer l’action des gènes. À l’in verse, une héritabilité à zéro signifie que la pathologie n’est pas génétique.
On considère qu’une maladie a une héritabilité forte si elle est supérieure à 0,40 (40%), moyenne pour une valeur comprise en 0,40 et 0,25 (40% et 25%) et faible si elle est inférieure à 0,25 (25%). La valeur de l’héritabilité varie selon les races mais aussi selon les auteurs.
Concernant la dysplasie coxofémorale, nous retiendrons les chiffres donnés par l’OFA (Orthopedic Foundation fot Animals). Ceux-ci sont calculés à partir des clichés radiographiques standards réalisés selon la procédure de dépistage officielle validée par la FCI:
- Le Chesapeake Bay: 0,56.
- Le Flatcoated: 0,49.
- Le Golden : 0,65.
- Le Labrador: 0,59.
- Le Nova Scottia: 0,64.
Nous ne disposons malheureusement pas de chiffre pour ce qui est du Curlycoated.
LES FACTEURS ENVIRONNEMENTAUX
Parmi les facteurs environnementaux on retiendra:
La race : Elle joue un rôle indéniable et important. Le facteur racial s’exprime au travers de l’angle entre l’axe des membres postérieurs et la colonne vertébrale ainsi que par la masse des muscles fessiers et plus précisément, leur masse relative par rapport à la masse corporelle totale (ce point explique probablement que les races de lévriers ne soient pas touchés par la dysplasie). Ces deux facteurs sont certes en partie déterminés par les facteurs exercice physique et alimentation mais aussi, en tant que caractéristique d’une race donnée, par des facteurs génétiques propres.
L’alimentation : C’est le facteur qui a donné lieu au plus grand nombre de travaux. Elle joue un rôle indiscutable et l’impact négatif d’une alimentation trop riche en protéines et en calcium pendant la période de croissance est aujourd’hui parfaitement reconnu. Allant dans le même sens, et en partie dépendant de l’alimentation, on citera aussi une prise de poids trop rapide et trop importante.
L’exercice physique : Il a toujours été montré du doigt. Or aucune étude précise n’a jamais été réalisée sur ce point. Un élément déjà évoqué parait cependant crucial : le bon développement des muscles fessiers. Pourquoi? Comme cela a été dit plus haut, la dysplasie se caractérise par une hyper laxité qui tend à faire sortir la tête fémorale de l’acétabulum (on parle d’hyper laxité active). Des muscles fessiers bien développés vont exercer une force contraire en plaquant et en stabilisant la tête fémorale au fond de l’acétabulum. L’hyper laxité n’est pas supprimée mais son intensité et ses effets délétères contrecarrés (on parle à présent d’hyper laxité passive). Le bon sens veut donc qu’on propose au chiot, pendant sa phase de croissance rapide, des exercices réguliers, sans excès et surtout, des exercices sans caractère brutal afin de n’engendrer aucune contrainte excessive su son squelette.
La stérilisation chirurgicale précoce : Ce facteur est d’émergence assez récente. Suspectée depuis plusieurs années, l’influence négative de cette chirurgie, si elle est pratiquée précocement, semble clairement ressortir de plusieurs travaux récents. Il faut le redire une fois de plus, cette chirurgie, pratiquée trop tôt, ne provoque pas l’apparition de la dysplasie, mais qu’elle constitue un facteur favorisant l’expression clinique d’une dysplasie chez un chiot génétiquement prédisposé. Le mécanisme n’est en rien lié à la prise de poids que peut engendrer cette chirurgie mais à un phénomène hormonal qui ne sera pas détaillés ici. On citera juste cette étude de 2020 menée par l’équipe de Bejamin L. Hart qui portait sur 33 races dont le Golden et le Labrador. Pour ce qui est du Golden, la fréquence retrouvée de dysplasie était, chez les animaux intacts de 5% chez les mâles et de 4% chez les femelles. Chez les mâles stérilisés avant 6 mois la fréquence grimpe à 2S% et àll % si la stérilisation à lieu entre 6 et 12 mois. Pour ce qui est des femelles, on obtient 18% pour une stérilisation avant 6 mois et 11% pour une stérilisation entre 6 et 12 mois. Le Labrador semble avoir plus de chance. Les fréquences, que ce soit chez les mâles ou les femelles, sont de 6% chez les animaux intacts contre 13% chez les mâles stérilisés avant 6 mois et 11% chez les femelles stérilisées avant 12 mois.
PROCÉDURE DE DÉPISTAGE OFFICIELLE
Le seul moyen de dépistage reconnu à ce jour par la FCI est la radiographie du bassin de face, réalisée obligatoirement sous anesthésie générale après l’âge de 12 mois. La position du chien pendant cet examen est d’une importance capitale : chien couché sur dos bassin parfaitement à plat, avec les membres postérieurs en traction, les deux fémurs devant être strictement parallèles avec les rotules bien centrées sur les fémurs (on dit que les rotules sont au zénith).
L’informatique a révolutionné le monde de la radiologie et les clichés de dépistage ont considérablement bénéficié de ces progrès. Explosion des clichés numériques de haute qualité face aux vieux clichés argentiques grossiers. Développement d’outils informatique d’aide à la lecture et à l’interprétation de ces clichés. Bref, on est sorti de la préhistoire du dépistage et cette méthode est devenue infiniment plus pertinente qu’il y a quelques années encore.
Pourquoi l’anesthésie générale est-elle obligatoire? Elle seule permet réellement d’obtenir les conditions nécessaires à la réalisation de clichés conformes aux critères de qualité exigés. Par ailleurs, de nombreuses études ont clairement montrées que l’absence d’anesthésie faussait les résultats du cliché de dépistage. En effet, un chien non anesthésié, même s’il est calme et docile, va conserver un tonus musculaire qui va pousser la tête du fémur dans l’acétabulum et donc masquer partiellement une hyperlaxité. À titre d’exemple, on citera une étude menée sur un groupe de 11 000 chiens de différentes races et dont les résultats, qui ne seront pas détaillés ici, montrent clairement que le fait de réaliser le cliché de dépistage chez un chien réveillé majore nettement le taux de chiens indemnes et réduit significativement le taux des chiens cotés C, D ou E. De ce fait, la réalisation de l’examen sous anesthésie a été rendue obligatoire. Les chiens soumis au dépistage de la dysplasie sont des animaux jeunes, le plus souvent en bonne santé. Dans une telle population d’animaux, le risque anesthésique est tout à fait négligeable comparativement aux autres causes de mortalité accidentelle. À titre de repère, le risque anesthésique d’un sujet en bonne santé est chiffré à 1 sur 1000 000 en anesthésie humaine.
Enfin il faut préciser que, contrairement aux idées reçues, le cycle sexuel des chiennes n’influence en rien le résultat d’une radiographie de dépistage. Faute de place, on passera sous silence les preuves scientifiques.
LE DÉPISTAGE PRÉCOCE PAR MESURE DE L’INDICE DE DISTRACTION
Ce sujet n’a probablement plus la même acuité que par le passé, au temps où les clichés argentiques n’avaient pas permis de faire baisser significativement la fréquence de cette maladie. Malgré les progrès réalisés, la méthode de dépistage officielle conserve ses limites. Le bon positionnement de l’animal en est une. La seconde consiste dans le fait qu’un cliché radiologique est une image réalisée à un temps Tet n’a aucune caractéristique dynamique. Or l’hyper laxité est une donnée dynamique dans le temps, même si ce temps est bref, et ne peut donc, le plus souvent, pas être évalué à sa juste valeur par un simple cliché radiologique. Enfin, l’héritabilité: la radiographie de dépistage standard n’a de valeur qu’une fois l’âge de 12 mois passé. A cet âge un certain pourcentage de chiens sera déclaré indemnes par la méthode classique alors qu’ils sont en réalité dysplasiques, les facteurs environnementaux leur ayant été favorables empêchant la traduction clinique et radiologique de la maladie au moment où les clichés de dépistage ont été réalisés.
La méthode de dépistage précoce a été mise au point dès 1983 par le professeur Gail Smith de l’université de Pennsylvanie. Cette technique radiologique permet, dès l’âge de 4 mois, d’établir un indice objectif, mesurable et donc chiffrable, de la laxité de la hanche chez le chien: la méthode Pennhip (Pennsylvania Hip lmprovement Program). Cette méthode utilise un dispositif appelé« distracteur » et mesure une valeur appelée « l’indice de distraction ». On réalise, en une seule séance et sous anesthésie, une série de 3 clichés radiologiques pratiqués chez un chien couché sur le dos: un cliché standard permettant d’évaluer l’aspect anatomique de l’articulation, et deux clichés en position forcée, l’un en compression (on pousse volontairement les têtes fémorales au fond de l’acétabulum) et l’autre en « distraction » avec le distracteur placé entre les pattes arrière du chien (qui écarte activement les têtes fémorales du fond de l’acétabulum). On peut ainsi visualiser et mesurer le degré d’étirement maximum de l’articulation, le résultat obtenu étant appelé indice de distraction. On mesure en fait le déplacement du centre de la tête fémorale entre le cliché en compression et celui en distraction. Lorsque cet indice est de 0, l’emboitement de la tête fémorale dans l’acétabulum est parfait et il n’existe aucune hyper laxité. Un indice égal à 1 signe une luxation complète de la hanche.Les valeurs normales de l’indice de distraction ont été établies statistiquement pour chaque race. On peut résumer les diverses études réalisées sur le sujet comme suit. Un indice inférieur à 0,3 correspond à une hanche parfaitement saine. À l’inverse, un indice supérieur à 0,7 témoigne d’une dysplasie sévère. Entre 0,3 et 0,7, le risque est à corréler à la valeur moyenne de la race. Pour le Labrador et le Golden, des valeurs autour de 0,5 sont acceptables. Quelle reste la place de la méthode en 2023? C’est une vraie question. Elle garde son intérêt ne serait-ce que pour sélectionner les futurs chiens guides d’handicapés et de déficients visuels. Mais son développement dans un milieu plus large a ouvert la porte à d’autres travers. Rajoutez-y l’amélioration de la fiabilité de la méthode habituelle générée par l’imagerie informatique et vous comprendrez pourquoi, malgré ses limites, la méthode classique reste d’actualité.
CRITÈRES ACTUALISÉS DE LECTURE DES RADIOGRAPHIES.
L’interprétation d’un cliché de dépistage de dysplasie ne se résume pas, loin de là, à la seule mesure de l’angle de Norberg Olsson.

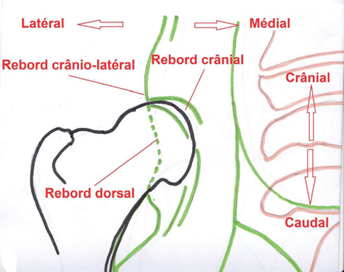
À quoi correspond cet angle ? Sa méthode de mesure a légèrement changé en 2006. Il unit deux lignes droites tracées sur la radiographie. La première unit toujours le centre géométrique des deux têtes fémorales. C’est la seconde qui a changé. Jadis elle allait du centre de chaque tête fémorale à
la pointe du rebord acétabulaire cranio-latéral correspondant. Depuis 2006 cette seconde ligne va du centre de la tête fémorale au point de jonction radiologique entre le rebord acétabulaire crânial et le rebord dorsal. L’illustration ci-dessus donne une idée un peu faussée de cet angle. Les deux droites évoquées sont en rouge, l’angle en bleu. Cette image fait toujours passer la seconde droite par la pointe du rebord crânio-latéral. Le point retenu depuis 2006 est un point radiologique, uniquement visible sur un cliché et non sur un squelette. Ce point peut ne pas être superposable au sommet du rebord crânio-latéral, repère retenu sur mon illustration, mais être situé un peu plus en dedans par rapport à lui. Ce changement, certes modeste, permet de mieux intégrer l’importance du recouvrement dorsal de la tête fémorale, de mieux« coller» à la réalité anatomique de la surface articulaire.
Mais bien d’autres critères sont pris en compte par le lecteur avant de donner son appréciation sous forme de cotation exprimée par une lettre allant de A à E. On considère que les chiens côtés A et B sont indemnes de dysplasie. De Cà E, ils présentent une dysplasie d’intensité croissante.
À la suite des progrès de l’imagerie radiologique déjà évoqués, on a pu établir des critères d’analyse de l’anatomie osseuse de la hanche beaucoup plus fins et précis permettant d’optimiser l’efficience de la lecture et la pertinence de la cotation. Ces nouveaux critères ont été ratifiés lors de la conférence internationale organisée par la FCI les 24 et 25 mai 2022 à Copenhague. Celle-ci réunissait les plus grands experts européens en la matière, la France étant représentée par le professeur Jean-Pierre Genevois à qui tous mes écrits sur la dysplasie doivent énormément. Il m’a fait l’amabilité de mettre à ma disposition la traduction de cette nouvelle grille qu’il a réalisée pour nos instances cynophiles nationales (voir plus bas). Elle me paraît beaucoup plus claire et fluide que la traduction littérale que j’en avais faite. Qu’il en soit ici chaleureusement remercié.
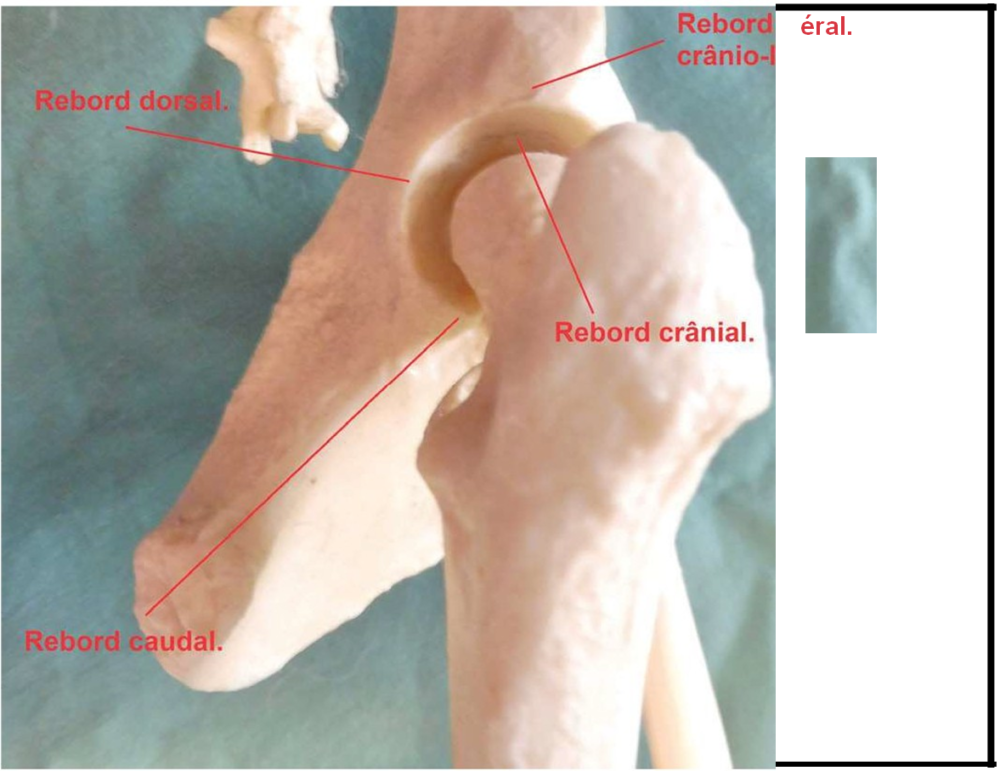
Le lecteur appréciera tout particulièrement, outre l’angle de Norberg-Olsson:
- L’aspect des surfaces osseuses dont celui de l’os sous-chondral (os situé juste sous le cartilage articulaire) des rebords de l’acétabulum. Il recherchera des signes d’usure et de déformation ses extrémités articulaires.
- L’aspect de l’interligne articulaire, cet espace situé entre les surfaces articulaires.
- Le positionnement de la tête fémorale dans l’acétabulum qui donne une certaine idée de la laxité de l’articulation. Seront particulièrement observés le centrage de la tête fémorale dans l’acétabulum et la position du centre de celle-ci par rapport au rebord dorsal de l’acétabulum. Quand la hanche est saine, ce point est situé médialement par rapport au rebord dorsal c’est à-dire plus proche du centre de la radiographie que le rebord Plus l’articulation est hyperlaxe, plus le centre de la tête fémorale va se déplacer latéralement c’est-à-dire s’éloigner du centre du cliché pour dans les cas sévères être plus éloigné de ce centre que le rebord acétabulaire dorsal.
J’ai essayé de donner une idée de ce que le lecteur voit sur le cliché radiographique dans le dessin ci-dessous. Y sont notées les principales clés nécessaires à la compréhension des critères tels qu’énoncés plus bas.
Stade A
- La tête fémorale est parfaitement centrée dans la cavité acétabulaire. L’interligne articulaire est étroit et régulier. Le contour de la tête fémorale est parallèle, ou pratiquement parallèle, au rebord acétabulaire crânial, sauf au niveau de la Fovéa Capitis (NDLR: petite fossette creusée au sommet de la tête fémorale dans laquelle se fixe le ligament rond).
- L’os sous-chondral du rebord acétabulaire crânial est une ligne étroite d’épaisseur régulière. Dans les articulations coxo fémorales d’excellente qualité, l’image de cet os sous-chondral peut ne pas atteindre le rebord crânio-latéral de l’acétabulum.
- Le rebord acétabulaire crânial est un arc de cercle bien délimité, parallèle au contour de la tête fémorale. Dans les articulations coxo-fémorales d’excellente qualité le rebord crânio-latéral de l’acétabulum entoure la tête fémorale caudo-latéralement. (NDLR: signifie que le rebord crânio latéral recouvre encore plus complètement la tête fémorale).
- Le centre de la tête fémorale est médial au rebord acétabulaire dorsal. L’angle de Norberg-Olsson est d’environ 105°(à titre de référence).
- Aucun signe d’arthrose n’est présent.
Stade B
- La tête fémorale est centrée dans la cavité acétabulaire. L’interligne articulaire est étroit, mais le contour de la tête fémoral et le rebord acétabulaire crânial peuvent ne pas être parallèles.
- L’os sous chondral du rebord acétabulaire crânial est une ligne étroite d’épaisseur régulière.
- Dans sa partie latérale, le rebord acétabulaire crânial est horizontal. Il forme une ligne droite dans un pan
- Le centre de la tête fémorale est médial ou situé sur la rebord acétabulaire L’angle de Norberg-Olsson est au moins de 100° (à titre de référence).
- Aucun signe d’arthrose n’est présent.
Stade C
- La tête fémorale n’est pas correctement centrée dans la cavité acétabulaire. Le contour de la tête fémorale et le rebord acétabulaire crânial sont divergents (non parallèles).
- L’os sous chondral du rebord acétabulaire crânial peut présenter un léger épaississement latéral et/ou un léger amincissement médial.
- Le rebord acétabulaire crânial est légèrement aplati, c’est-à dire qu’il s’éloigne crânio-latéralement de la tête fémorale. (NDLR : participe à la divergence évoquée dans la première ligne).
- Le centre de la tête fémorale est situé sur le rebord acétabulaire dorsal, ou latéralement à ce dernier.
- Une subluxation latérale ou caudale de la tête fémorale peut être présente.
- L’angle de Norberg-Olsson est voisin de 100° (à titre de référence).
- Des signes d’arthrose peuvent être présents.
Stade D
- La tête fémorale n’est pas correctement centrée dans la cavité acétabulaire. Le contour de la tête fémorale et le rebord acétabulaire crânial sont nettement divergents.
- L’os sous-chondral du rebord acétabulaire crânial présente un léger épaississement latéral et/ou un léger amincissement médial.
- Le rebord acétabulaire crânial est aplati. Il s’écarte crânio latéralement de la tête fémorale.
- Le centre de la tête fémorale est situé latéralement au rebord acétabulaire dorsal.
- Une subluxation latérale ou caudale de la tête fémorale peut être présente.
- L’angle de Norberg-Olsson est supérieur à 90° (à titre de référence).
- Des signes d’arthrose peuvent être présents.
Stade E
- Modifications marquées de l’articulation liées à la dysplasie. Un remodelage ou une déformation de l’acétabulum et/ou de la tête fémorale peuvent être présents.
- Le contour de la tête fémorale et l’os sous-chondral du rebord acétabulaire crânial sont divergents. Le rebord acétabulaire crânial est aplati.
- Le rebord acétabulaire crânial est épaissi latéralement, jusqu’à hauteur du rebord crânio-latéral. Cet épaississement du rebord acétabulaire crânial peut être absent lors de luxation de l’articulation.
- Le rebord acétabulaire crânial est nettement Il s’écarte crânio-latéralement de la tête fémorale. Dans certains cas, le rebord crânio-latéral de l’acétabulum a disparu.
- Le centre de la tête fémorale est situé latéralement au rebord acétabulaire dorsal.
- Luxation ou subluxation de la tête fémorale.
- L’angle de Norberg-Olsson est inférieur à 90° (à titre de référence).
- Des signes d’arthrose peuvent être présents.
EN CONCLUSION
Compte-tenu de la complexité du mode de transmission génétique et du flou régnant autour cette question, l’incertitude est de mise et la maîtrise des risques environnementaux doit être la règle chez tous les chiots pendant leur croissance. Le meilleur moyen de limiter la diffusion de cette maladie reste le dépistage systématique des chiens reproducteurs et de n’utiliser que des animaux déclarés indemnes, eux-mêmes issus de reproducteurs indemnes, mais également, d’effectuer un contrôle a posteriori sur la descendance afin de se convaincre du patrimoine génétique des parents. Un petit tableau pour alimenter la réflexion:
|
Croisement entre : 1 Chien indemne |
Chien dysplasique |
|
|
Chien indemne |
70% chiens indemnes |
50% chiens indemnes |
|
Chien dysplasique |
50% chiens indemnes |
7% chiens indemnes |
Et pour finir, une petite phrase que j’aime bien, due à un ancien président de notre club, le baron Elie De Rothschild : « La dysplasie de hanche, c’est comme être enceinte. On n’est pas un peu enceinte, on l’est ou on ne l’est pas!!»
Avec mes plus vifs remerciements au professeur J.P.Genevois de l’école vétérinaire de Lyon. Merci pour son aide documentaire et sa grande patience à mon encontre au cours des nombreux échanges que nous avons sur ce sujet depuis tant d’années.
Synthèse, actualisation, illustration et rédaction
Dr. Jean-Marc Wurtz
POST-SCRIPTUM : LA DYSPLASIE COXOFÉMO RALE UNILATÉRALE ? UN LEURRE DÉCOULANT DES LIMITES DE LA MÉTHODE DE DÉPISTAGE OFFICIELLE.
Un cas de dysplasie soumis à discussion sur la page Facebook de notre club a récemment conduit à d’intenses échanges. Ils mettaient en lumière le doute qui subsiste dans certains esprits quant au caractère exclusivement génétique de cette affection avec notamment comme argument, la dysplasie unilatérale, ne touchant qu’une seule hanche.« Si c’est génétique, ça touche les deux côtés.Le fait qu’il y ait des chiens qui n’ont qu’une seule hanche de touchée prouve bien qu’il y a des dysplasies non génétiques». J’ai donc une fois de plus échangé sur le sujet avec le professeur Genevois et voici sa réponse.
Dans la quasi-totalité des cas, la dysplasie est bilatérale. Lorsque, chez un chien qui ne présente pas de développement arthrosique, une hanche parait normale sur la radio de dépistage alors que la hanche opposée est « déplacée » latéralement en raison de l’hyperlaxité, c’est tout simplement que la radio n’a pas mis en évidence l’hyperlaxité sur la hanche
qui apparait comme « saine ». Voici un exemple : sur cette radio d’un rottweiler femelle de 2 ans, la hanche située du côté gauche est dysplasique, alors que la hanche située du côté droit est parfaitement normale.
Sur cette seconde radio du même chien, prise dans la même série de clichés par le vétérinaire, on s’aperçoit que la hanche du côté droit est en fait aussi mauvaise que la gauche.
Pour rappel, la dysplasie est un problème de laxité excessive des articulations coxo-fémorales, ce qui signifie que les têtes fémorales peuvent« s’écarter» latéralement de manière plus ou moins importante par rapport à la cavité acétabulaire. La principale limite du procédé actuel de dépistage de la OH, la radio standard, est qu’il ne permet pas de mettre en évidence de manière systématique l’hyperlaxité coxo-fémorale. Au moment où l’on fait la radio, même sur un chien correctement anesthésié, il peut se faire que le déplacement ne se manifeste pas, le chien paraîtra normal. C’est un faux négatif, ou le déplacement ne se voit que d’un côté (comme dans notre exemple).
Chez des chiens qui présentent une OH unilatérale avec arthrose, l’affection est en fait bilatérale, comme le montre l’exemple ci-dessous (NDLR : Les radiographies jointes ne peuvent être publiées pour une raison de format). Sur la première radio la hanche du côté droit est très arthrosique et notée D, alors que la hanche du côté gauche est A. Sur la seconde radio, on s’aperçoit que la hanche du côté gauche présente une importante hyperlaxité et sera notée également D sur ce second cliché. On ne sait pas pourquoi, dans ce type de cas, l’arthrose touche plus fortement une articulation que l’autre, alors que le degré de laxité est symétrique. La règlementation FCI dit qu’en cas de radios multiples chez un même animal, c’est le cliché qui montre la laxité la plus prononcée qui doit être prise en compte pour la notation des hanches.
La dysplasie du coude.
Il s’agit d’un développement anormal de l’articulation huméro-radio-ulnaire conduisant à l’apparition de lésions d’arthrose précoces engendrant une douleur et une gêne fonctionnelle chez l’animal atteint. Première cause de boiterie d’un membre antérieur chez le chien, elle est donc la cause de lésions irréversibles et potentiellement invalidantes dont le diagnostic est essentiel pour permettre un traitement le plus précoce possible, seul garant d’un bon pronostic.
Le vocable de dysplasie du coude regroupe en fait quatre lésions différentes dites lésions primaires car à l’origine de la pathologie :
- La non union du processus anconé (NUPA).
- La fragmentation du processus coronoïde médial de l’ulna (FPCM).
- L’ostéochondrite disséquante du condyle huméral médial (OCD).
- L’incongruence articulaire (IA).
Avec la dysplasie de la hanche, il s’agit de la maladie ostéoarticulaire héréditaire la plus répandue dans l’espèce canine. Elle est donc transmissible à la descendance et, comme pour la hanche, peut voir l’intensité de son expression clinique modulée par des facteurs extérieurs dits environnementaux tels l’alimentation, le poids et l’exercice physique. Mais le sexe de l’animal est aussi à prendre en compte. Elle est bilatérale, c’est-à-dire qu’elle touche les deux coudes, dans 50% des cas. Elle touche principalement les races de grande et moyenne taille. Avec le Rottweiler et le Bouvier bernois, Labradors et Goldens Retrievers sont les races les plus exposées. Tout comme la dysplasie de hanche, le meilleur moyen de la combattre est la prévention par un dépistage systématique des chiennes et des chiens reproducteurs et d’écarter du circuit de la reproduction les animaux atteints.

Historique.
Longtemps éclipsée, à tort, par la dysplasie de la hanche, elle fait l’objet d’études récentes, considérablement motivées par l’IEWG (International Elbow Working Group). Fondé en 1989, c’est un groupe international rassemblant des chirurgiens, des radiologues, des généticiens et des éleveurs canins préoccupés par les pathologies du coude.
Le terme de dysplasie du coude est né en 1965 des travaux de E.A. Corley et W.D. Carlson. Il désignait alors l’arthrose généralisée du coude. C’est suite aux travaux de l’IEWG que fut donnée la définition actuelle et ce, en 1993 : « développement anormal du coude qui rassemble quatre lésions primaires (NUPA, FPCM, OCD et IA) conduisant à une arthrose prématurée du coude ».
Par la suite, l’IEWG établit en 1998 un protocole de dépistage harmonisé au niveau international, basé sur un examen radiologique du coude avec classification en quatre catégories allant de ED0, absence de dysplasie, à ED3, dysplasie sévère (ED = Elbow Dysplasia). Cette procédure de dépistage a été validée par le FCI et c’est donc celle que nous appliquons en France aujourd’hui.
En France, le premier club de race à instaurer une procédure de dépistage fut, comme pour la dysplasie de la hanche, le Club Français du Berger Allemand et ce en 1997. Rappelons que ce club avait mis en place le protocole hanche en 1975…on mesure le décalage d’intérêt porté au coude par rapport à la hanche. En 1999 ce fut au tour de l’Association Française des Bouviers Suisses et du Club Français du Rottweiler de recommander le dépistage des reproducteurs, suivis en 2004 par le Retriever Club de France.
Anatomie du coude.
Le coude est une articulation complexe qui sépare le bras de l’avant-bras. Elle unit l’humérus, os du bras, au radius et à l’ulna (anciennement appelé cubitus) qui constituent l’avant-bras. Le coude réunit en fait trois articulations en une. Celle entre l’humérus et le radius, celle entre l’humérus et l’ulna et celle entre le radius et l’ulna d’où le vocable barbare d’articulation huméro-radio- ulnaire. Au niveau du coude, l’humérus présente deux renflements arrondis appelés condyles. L’un est à la face latérale (externe) du coude et est appelé condyle latéral, l’autre à la face médiale (interne, celle qui regarde vers le thorax du chien) et est appelé condyle médial. Entre ces deux condyles se trouve un sillon appelé trochlée. Cette trochlée est creusée à sa partie haute d’un petit orifice, le foramen supratrochléaire.
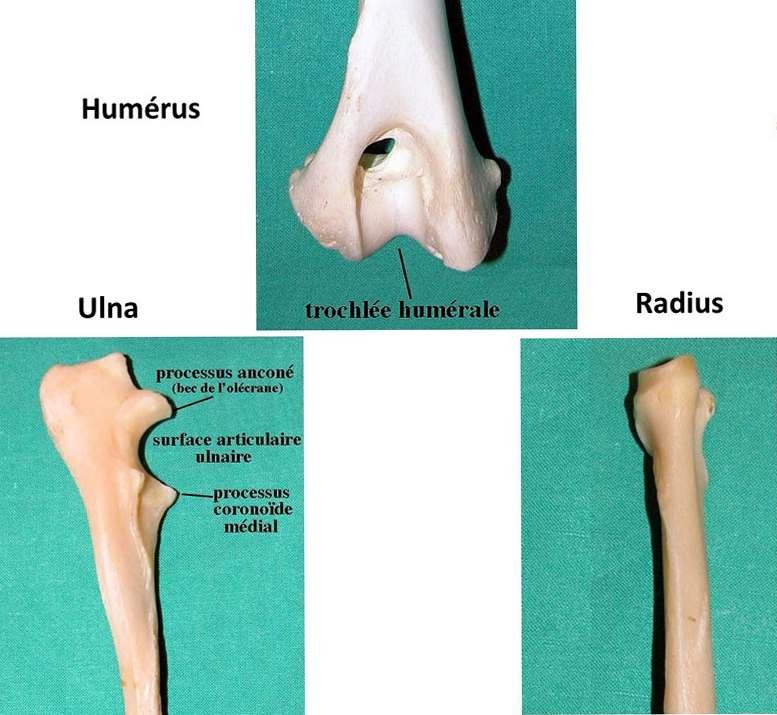
L’humérus s’articule avec le radius par l’intermédiaire de son condyle latéral selon un schéma assez simple, entrant en contact avec la tête du radius en forme de cupule. L’articulation avec l’ulna est plus complexe. L’ulna présente une petite partie en cupule qui va entrer en contact avec le condyle médial de l’humérus. Mais elle présente surtout une excroissance se prolongeant vers le haut qu’on appelle l’olécrâne. Ce dernier va s’insérer dans la trochlée, telle une corde sur une poulie. C’est par le biais de cette imbrication « corde-poulie » qu’est assuré le maintien dans l’axe de l’avant- bras par rapport au bras dans les mouvements de flexion et d’extension du coude. A la face antérieure (avant) de l’olécrâne, un petit bec osseux, le processus anconé (encore appelé bec de l’olécrâne) qui joue un rôle fondamental dans la stabilité du coude en extension. Quand le coude arrive à la limite de l’extension, le processus anconé se clipse dans le foramen supratrochéaire et verrouille le mouvement. Enfin, à cet endroit entrent en contact le radius et l’ulna en une articulation radio-ulnaire, sollicitée dans les mouvements de rotation de l’avant- bras et de la main. Un manchon ligamentaire solidarise le radius à l’ulna, le ligament annulaire du coude. Au niveau de cette zone de contact, l’ulna présente une crête osseuse saillante, le processus coronoïde médial.
L’ensemble de ces trois articulations est entouré d’une capsule articulaire et de ligaments. A l’intérieur de la capsule, les os recouverts de leur cartilage articulaire baignent dans le liquide synovial qui assure la lubrification du système et assure l’apport au cartilage articulaire des nutriments dont il a besoin.
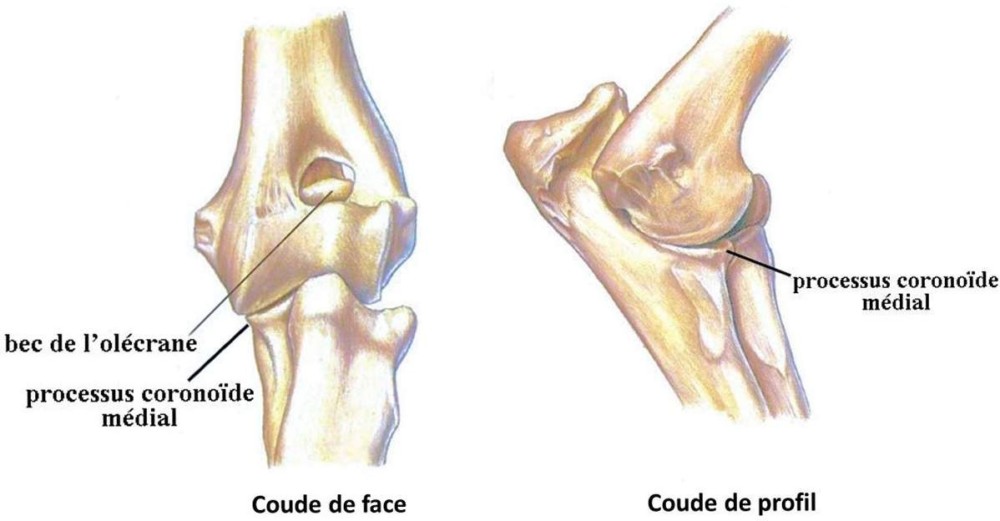
Les lésions primaires.
Nous l’avons dit dans l’introduction, elles sont au nombre de 4 : La NUPA, la FPCM, l’OCD et l’IA. Labradors et Goldens sont principalement concernés par la FPCM et/ou l’OCD avec une atteinte bilatérale dans 50% des cas.
- La NUPA : Chez les chiens de taille moyenne et grande, le processus anconé est le siège d’un centre d’ossification constitué de cartilage qui se soude, selon les races, entra 14 et 20 semaines. La NUPA consiste en l’absence d’ossification de ce cartilage à 20 semaines. Parmi les différentes hypothèses avancées, celle d’un trouble de la vascularisation du cartilage qui empêche son ossification. La race la plus concernée est le berger Allemand.
- La FPCM : Cette lésion est très souvent bilatérale et peut être associée à l’OCD. Elle consiste en une fissuration de la pointe du processus coronoïde médial, le plus souvent en un seul fragment, parfois en plusieurs. Ce ou ces fragments peuvent se détacher et se déplacer dans la cavité Mais le plus souvent, ils restent attachés au ligament annulaire du coude. Le mécanisme exact de cette lésion n’est pas clairement établi malgré de nombreuses hypothèses avancées.
- L’OCD : Très souvent associée à la FPCM, elle reste cependant moins fréquente que cette dernière dans sa forme isolée. Les formes bilatérales sont très fréquentes. Des fragments du cartilage articulaire du condyle huméral médial se détachent et vont flotter dans la cavité articulaire, entravant le bon mouvement de l’articulation. En cause, un défaut d’ossification de l’os situé juste en dessous de ce cartilage articulaire appelé os sous-chondral. Au début cette faiblesse osseuse est compensée par un épaississement du Une fois devenu trop épais, les couches profondes du cartilage ne sont plus nourries par le liquide synovial, se nécrosent et se détachent de l’os.
- L’IA : Elle procède d’un défaut de synchronisation de la croissance entre le radius et l’Ulna conduisant à une absence de parallélisme entre les surfaces articulaires. Les surfaces articulaires du radius et de l’ulna ne sont donc plus alignées dans un même plan. Une anomalie elliptique de la trochlée, c’est-à- dire de sa courbure, peut aussi en résulter. Les rapports des différentes surfaces articulaires entre elles ne sont donc plus respectés et la stabilité de l’articulation et l’harmonie de ses mouvements rompus.
Sur la photo ci-dessous, on retrouve de gauche à droite la NUPA, la FPCM et l’IA. Sur cette dernière, on visualise bien la disproportion de longueur entre radius et ulna avec ce décalage en « marche d’escalier » en regard de la flèche rouge.
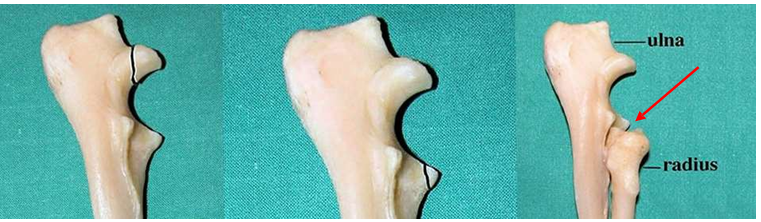
Diagnostic de la dysplasie de coude chez un chien atteint.
La dysplasie de coude est la première cause de boiterie d’un membre antérieur chez le chien et est donc le premier motif de consultation.
Les signes cliniques apparaissent en moyenne entre 4 et 8 mois avec des écarts pouvant varier selon la nature des lésions primaires. Cette maladie reste en outre souvent infra clinique retardant l’âge auquel était posé le diagnostic. Certaines dysplasies, restées silencieuses car masquées par une bonne hygiène de vie, vont décompenser après un traumatisme mineur par exemple et amèneront à consulter plus tardivement. Or plus le diagnostic est posé tôt, meilleur est le pronostic.
La démarche diagnostique va débuter par l’anamnèse, c’est-à-dire l’histoire de l’installation des signes cliniques. Puis viendra l’examen clinique en deux temps, en dynamique puis en statique. Cette étape est fondamentale car « passer à côté » d’une dysplasie du coude peut avoir des répercussions dramatiques sur l’articulation.
Le vétérinaire observera le chien en mouvement pour évaluer sa démarche et détailler sa boiterie. Une raideur des antérieurs sera recherchée. L’examen en statique se fera chien assis puis debout. On appréciera ainsi la répartition et l’importance des appuis de chaque membre, d’éventuelles modifications posturales et l’on recherchera des déformations des profils et des axes osseux. Puis viendra l’étape de la palpation et de la manipulation des membres antérieurs. La palpation recherchera des points douloureux et d’éventuelles déformations ou anomalie de consistance des tissus. La mobilisation explorera la mobilité du coude en mettant l’articulation en position forcée dans les quatre mouvements qu’elle permet. Flexion et extension puis pronation et supination de l’avant-bras et de la main. On recherchera ainsi une douleur provoquée, très fréquente en extension forcée. On mesurera les amplitudes de ces mouvements pour rechercher une limitation de celles-ci. Les amplitudes maximales chez un chien aux coudes normaux sont les suivantes. Lorsque le membre est en extension maximale, l’avant-bras forme avec le bras un angle ouvert vers l’avant de 165-170 degrés, angle qui passe à 40-50 degrés en flexion maximale. Le mouvement de pronation consiste à tourner l’avant-bras et la main vers l’intérieur et peut atteindre 45 degrés. La supination est le mouvement en sens inverse, tourné vers l’extérieur et est de 70 degrés.
Au moindre doute clinique, la démarche diagnostique va se poursuivre par un bilan radiologique. La radiographie visualise parfaitement les lésions d’arthrose mais ses performances en matière d’identification des lésions primaires est variable. Nous y reviendrons dans le dernier chapitre. Mais malgré ses limites, la radiographie standard a pour elle un coût raisonnable et un accès facile et rapide. Elle est intéressante mais pas suffisante. L’examen de choix, pour le dépistage individuel, reste le scanner. Il nécessite certes d’être réalisé sous anesthésie générale, son coût est élevé, mais il précise la nature exacte des lésions avec une sensibilité évaluée à presque 88%. A noter que certains vétérinaires, au terme d’un examen clinique faisant suspecter une dysplasie de coude, passent directement au scanner sans passer par la radiographie standard.
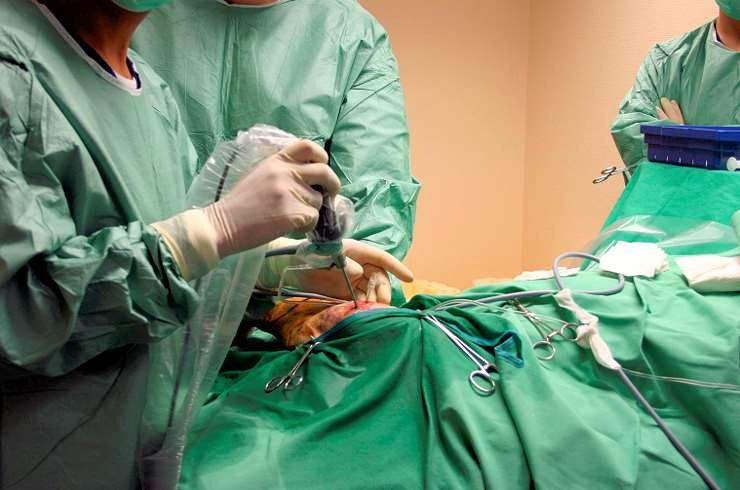
Une fois le diagnostic posé vient le choix du traitement, chapitre qui ne sera pas abordé ici. Nous ne parlerons que d’une seule technique : l’arthroscopie du coude. Pourquoi celle-ci ? Car elle est à la fois une méthode diagnostique et parfois thérapeutique. C’est une intervention chirurgicale très peu invasive, réalisée sous anesthésie générale et en ambulatoire, qui consiste à introduire un tube optique à l’intérieur de l’articulation. Ce tube est muni d’une caméra reliée à un écran qui permet à l’opérateur de visualiser en direct l’intérieur de l’articulation et de faire une exploration complète et détaillée des structures. Cette technique permet de faire un bilan des lésions avec une précision supérieure à celle du scanner puisque sa sensibilité est évaluée à 95-98% ! Pour certaines lésions primaires, et on citera notamment l’OCD, l’arthroscopie permettra en même temps un geste thérapeutique qui consiste en un nettoyage de la cavité articulaire et en l’élimination des débris de cartilage qui s’y promènent. Précisons pour finir que l’arthroscopie peut s’effectuer sur les deux coudes en un même temps opératoire.
Quel est le pronostic après traitement ? La majorité des études constatent une amélioration après traitement dans 85% des cas en moyenne si le diagnostic est posé tôt. Le degré d’arthrose et l’âge du chien au moment de la mise en œuvre du traitement influencent bien entendu le pronostic.
Génétique, héritabilité et influence du sexe.
Avant d’aborder les deux chapitres à venir, deux définitions méritent d’être rappelées, celle du génotype et celle du phénotype. On appelle génotype l’ensemble des gènes présents dans les cellules de l’organisme. Il n’est visible qu’en laboratoire. Une grande partie de ces gènes reste silencieuse. Seuls quelques gènes vont s’exprimer, conférant à chaque être vivant ses caractéristiques propres visibles à l’œil nu. L’ensemble de ces caractéristiques observables constitue le phénotype, la partie visible de l’iceberg. Mais ce qui est silencieux continue de se transmettre à la descendance pour ne parfois prendre la parole que bien des générations plus tard.
Il est aujourd’hui admis que, comme la dysplasie de hanche, celle du coude est d’origine génétique, donc transmissible à la descendance selon les lois de la génétique quantitative. Là aussi le mode de transmission exact est inconnu et complexe. Le modèle faisant actuellement consensus est celui d’une transmission polygénique à pénétrance incomplète. Polygénique signifie que plusieurs gènes sont en cause alors que la notion de pénétrance incomplète explique en partie les différents types phénotypiques de dysplasie, autrement dit les différents degrés de gravité de l’atteinte observable au sein de la population canine. A cela il faut rajouter l’hypothèse de gènes majeurs conditionnant le développement de l’une ou l’autre des lésions primaires. C’est-à-dire que les chiens dysplasiques auraient une partie de leur génotype propre au type de lésion primaire dont ils souffrent. Après avoir effleuré le génotype, venons-en à ce qui est visible, le phénotype dysplasie. Comme pour la hanche, la dysplasie du coude est une maladie génétique à expression phénotypique variable. En effet, certains facteurs extérieurs, appelés facteurs environnementaux, vont pouvoir influencer la traduction clinique de la maladie et son intensité. D’où la notion d’héritabilité.
L’héritabilité est une donnée statistique relative à une population, en l’occurrence ici, à une race canine. Sa valeur relève d’un calcul mathématique. Elle représente le « poids » des facteurs génétiques dans l’expression clinique de la maladie héréditaire concernée. Elle explique de ce fait la variabilité des phénotypes entre individus ayant un patrimoine génétique identique. Elle varie de 0 à 1 et est souvent exprimée en pourcentage.
Une héritabilité à 1 (100%) signifie que les facteurs environnementaux sont incapables d’influencer l’action des gènes. A l’inverse, une héritabilité à zéro signifie que la pathologie n’est pas génétique.
On considère qu’une maladie a une héritabilité forte si elle est supérieure à 0,40 (40%), moyenne pour une valeur comprise en 0,40 et 0,25 (40% et 25%) et faible si elle est inférieure à 0,25 (25%). La valeur de l’héritabilité varie selon les races mais aussi selon les auteurs.
Les facteurs environnementaux sont bien connus au premier rang desquels l’alimentation, le poids du chien mais probablement aussi la nature de l’activité physique qu’il aura eu à assumer pendant sa croissance.
Les données de la littérature sont variables et ne permettent pas de chiffrer avec précision la valeur de l’héritabilité de la dysplasie de coude dans nos races. Une étude finlandaise portant sur des radios de différentes races durant la période 1990-2000 retrouvait une héritabilité faible chez le labrador mais sur un nombre peu significatif de clichés étudiés. Le Golden ne faisait pas partie des races étudiées. En 2018, une étude rétrospective néo-zélandaise portant sur 4100 radios lues dans 4 races dont le Labrador et le Golden (les deux autres étaient le Berger Allemand et le Rottweiler) retrouvait une valeur de 30% pour le Golden et 46% pour le Labrador.
Dernier facteur à prendre en compte, le sexe de l’animal. L’incidence semble être réellement supérieure chez les mâles que chez les femelles, certaines études allant jusqu’à parler d’une incidence deux fois supérieure. De plus, les stades ED3 sont beaucoup plus fréquents chez les mâles que chez les femelles. Différentes hypothèses ont été avancées. La génétique avec l’intervention d’un gène mineur lié à l’X mais l’équipe ayant formulé cette hypothèse reconnait qu’elle ne correspond pas à un modèle classique de transmission sexuelle. Ont encore été évoqués les courbes de croissances différentes entre les deux sexes, les différences de statut hormonal et le fait que les mâles sont plus lourds que les femelles. Poids et courbe de croissance, deux facteurs qui ont bien évolués au fil du temps…Certaines études ont pointé du doigt le fait que le nombre de chiens atteints et la sévérité de leur atteinte était sous-estimés si les radios étaient faites entre 12 et 24 mois et ce, surtout chez les femelles. Serait-ce là une explication de plus ? Mais d’autres études viennent contredire ces résultats affirmant que l’âge auquel est réalisé le dépistage n’a aucune influence. Mais les faits sont là ! Et pour en revenir à l’héritabilité, un article britannique récent donnait, chez le Labrador et le Golden, une héritabilité de 77% chez les mâles et
« seulement » 45% chez les femelles sans faire de distinction entre les deux races.
En fait, il n’existe que peu d’études statistiques réellement significatives sur la maladie. La faute en est au faible taux de dépistage comparativement à celui de la dysplasie de hanche. Si le dépistage de cette dernière est entré dans les mœurs, on estime qu’actuellement, seul environ 10% des chiens LOF sont testés en France, toutes races confondues. Et pour clore ce chapitre, il faut se rappeler qu’en 2023, un peu moins de 30 races, dont heureusement les nôtres, bénéficiaient de recommandation de dépistage émises par leur club de race ! Par ailleurs, seuls le Labrador et le Golden retriever sont cités ponctuellement, les autres de nos races jamais. (Ce sont par ailleurs toujours les mêmes races qui sont majoritairement concernées par les publications). Ramené aux statistiques de la SCC sur ces trois dernières années, ce constat colle à la réalité avec un seul cas de dysplasie déclaré chez le Flatcoated et aucun chez le Curlycoated, le Nova Scottia et le Chesapeake.
Dépistage de masse chez les animaux destinés à la reproduction.
Le dépistage chez les sujets destinés à la reproduction utilise le protocole mis au point par l’IEWG et validé par la FCI. Il consiste en un examen radiographique des deux coudes, effectué chez un chien âgé d’au minimum 12 mois. Comme pour la dysplasie de la hanche, les radiographies accompagnées de l’identification du chien sont lues et interprétées par un lecteur officiel. Le protocole radiologique nécessite trois clichés pour chaque coude, on parle de trois incidences :
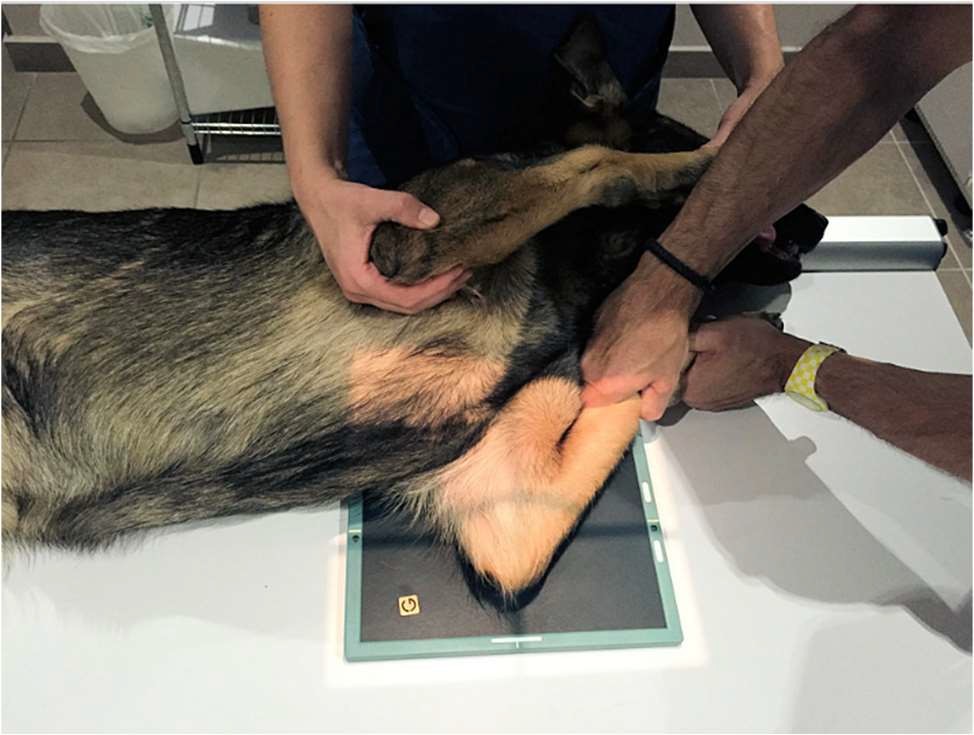
- L’incidence médio-latérale en flexion : il s’agit d’un cliché prenant le coude de profil, ce dernier positionné en flexion à environ 45 degrés.
- L’incidence médio-latérale en extension : il s’agit également d’un cliché de profil mais le coude est à présent placé en extension complète.

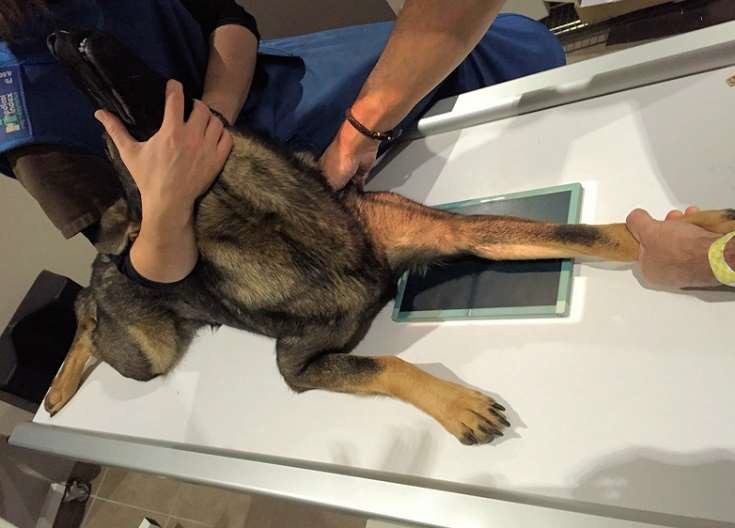
- L’incidence cranio-caudale oblique : le membre antérieur est radiographié de face, chien couché sur le ventre et coude à plat sur la table de radio. L’avant-bras et la main sont placés en rotation interne.
Quid de l’anesthésie ? Contrairement au dépistage de la hanche qui nécessite un relâchement musculaire parfait du chien pour apprécier l’hyperlaxité, les radiographies du coude ne sont en rien influencées par le tonus musculaire de l’animal. On peut donc concevoir un dépistage animal réveillé. Cependant, le positionnement des pattes est assez inconfortable et certains chiens gagnent en confort à bénéficier d’une petite sédation pour l’examen. L’idéal est bien entendu d’associer le dépistage du coude à celui de la hanche pour bénéficier des avantages de l’anesthésie.
L’image ci-dessous montre les différents clichés obtenus avec de gauche à droite, l’incidence médio-latérale en flexion puis celle en extension et enfin, l’incidence cranio-caudale oblique.
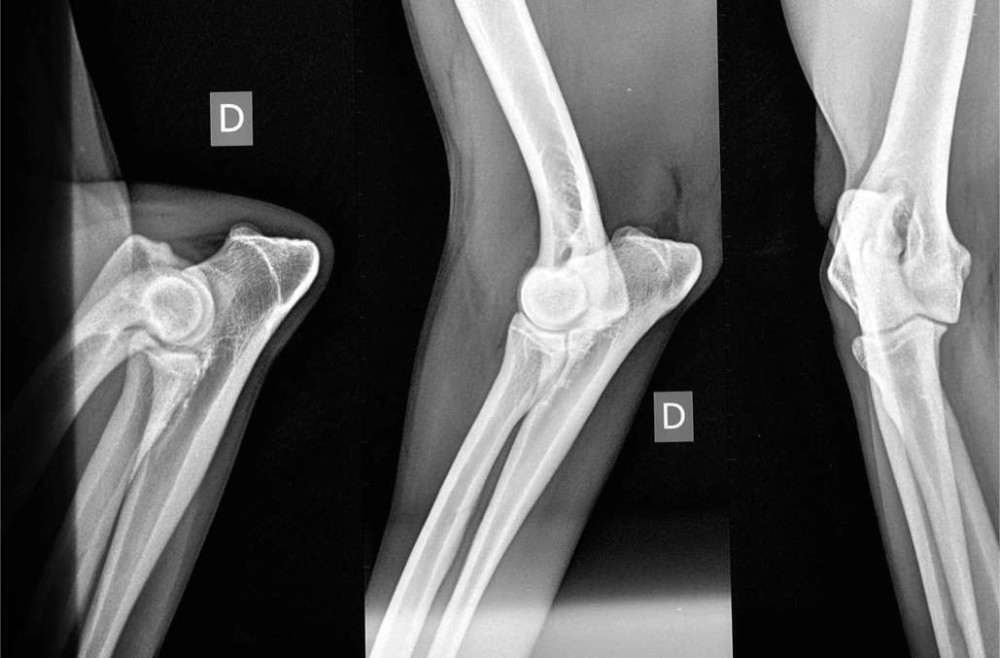
Le tableau ci-dessous résume les différents stades de classification de la dysplasie du coude et les critères de lecture tels que validés par la FCI.
|
Stade de dysplasie |
Présence d’arthrose ou de lésion primaire. |
Anomalies anatomiques radiologiques visibles. |
|
ED 0 = coude normal SL = stade limite |
Absence d’arthrose. |
Aucune anomalie visible. Absence d’incongruence, d’hyper minéralisation et d’arthrose. |
|
ED 1 = dysplasie légère. |
Arthrose peu marquée. |
Ostéophytes d’une taille < 2mm. Signes très légers d’hyper minéralisation à la base du processus coronoïde. Incongruence radio-ulnaire < 2mm. |
|
ED 2 = dysplasie moyenne. |
Arthrose modérée ou suspicion de lésion primaire. |
Ostéophytes d’une taille comprise entre 2 et 5mm. Densification nette à la base du processus coronoïde médial. Incongruence radio-ulnaire de 3 à 5mm. Signes indirects évoquant la présence d’une lésion primaire (NUPA, FPCM, OCD). |
|
ED 3 = dysplasie sévère. |
Arthrose sévère ou présence d’une lésion primaire. |
Ostéophytes d’une taille > 5mm. Incongruence radio-ulnaire > 5mm. Présence d’une lésion primaire (NUPA, FPCM, OCD). |
Qu’en est-il de la fiabilité de ce dépistage ? Les radiographies standard sont parfaitement adaptées à la visualisation et la quantification des lésions d’arthrose. Elles sont performantes pour l’identification de la NUPA sur les clichés de profil et pour l’identification de l’OCD sur les vue obliques. Elles sont par contre plus décevantes pour l’identification de la FPCM. En effet la FPCM est difficile à visualiser et est surtout évoquée sur la présence de signes indirects. La sensibilité est évaluée à seulement 60%. Par contre, l’IA est bien visualisée à la radiographie et seule son évaluation quantitative est souvent inexacte.
Procédure imparfaite donc mais pas inutile et qui a le mérite d’exister. Encore faut-il y faire appel. Le recours au scanner pour un dépistage de masse, certes idéal en théorie, est en pratique inconcevable pour des raisons non seulement d’accessibilité à un appareil de scanner mais surtout pour des raisons évidentes de coût. De plus, contrairement à la radiographie standard, il n’existe aucune procédure précise et faisant consensus quant à la réalisation pratique de l’examen.
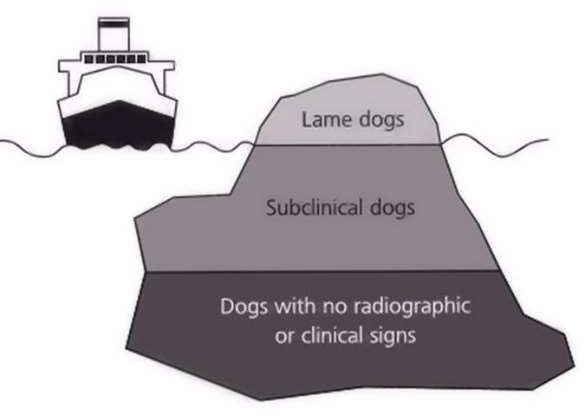
En guise de conclusion, je citerai le professeur Marck Flückiger de l’école vétérinaire de Zürich en Suisse qui a été un grand précurseur dans le domaine du dépistage et de la lutte contre la dysplasie du coude. « Les chiens malades sont évidents à identifier et représentent la partie visible de l’iceberg. Immergés sous la surface, la grande cohorte des chiens ayant une atteinte infra clinique mais un fort potentiel à engendrer des chiots dysplasiques. Ce sont eux qu’il faut identifier et le seul moyen de le faire reste le dépistage systématique de tous les reproducteurs afin d’éliminer au plus tôt du circuit de la reproduction les chiens atteints ».
Remerciements :
- Une fois encore au professeur Jean-Pierre Genevois pour sa disponibilité, les échanges qu’il m’a accordés sur le sujet et l’abondante documentation qu’il a mis à ma disposition.
- A madame le docteur Mathilde Fostier-Humbert pour le partage de sa thèse (Prévalence de la dysplasie de coude chez 13 races de chiens en France, une étude rétrospective à partir de dépistages radiographiques de 2002 à 2022) soutenue à Lyon le 23 octobre 2023. Ni le Labrador ni le Golden ne figurent malheureusement dans ce remarquable travail.
Rédaction Dr. Jean-Marc Wurtz. Juillet 2024.
